Las guías de práctica clínica (GPC) constituyen una herramienta fundamental para orientar la toma de decisiones en medicina en base a las evidencias. Sin embargo, cuando una guía recomienda una intervención de manera “fuerte”, ¿estamos realmente ante una decisión respaldada por evidencia científica sólida? ¿O estamos asumiendo, quizá sin saberlo, que la certeza de dicha recomendación se corresponde automáticamente con la calidad de la evidencia disponible?
El estudio Level of Evidence and Strength of Recommendations in US Medical Society Clinical Practice Guidelines, 2019–2023: A Cross-Sectional Analysis aborda, precisamente, esta cuestión. Se trata de un estudio transversal que analiza 7.582 recomendaciones incluidas en 309 guías publicadas entre 2019 y 2023 por 23 sociedades médicas en Estados Unidos. El objetivo fue evaluar la concordancia entre dos elementos clave: el nivel de evidencia que respalda una intervención, y la fuerza de recomendación con la que esta se propone en la práctica clínica.
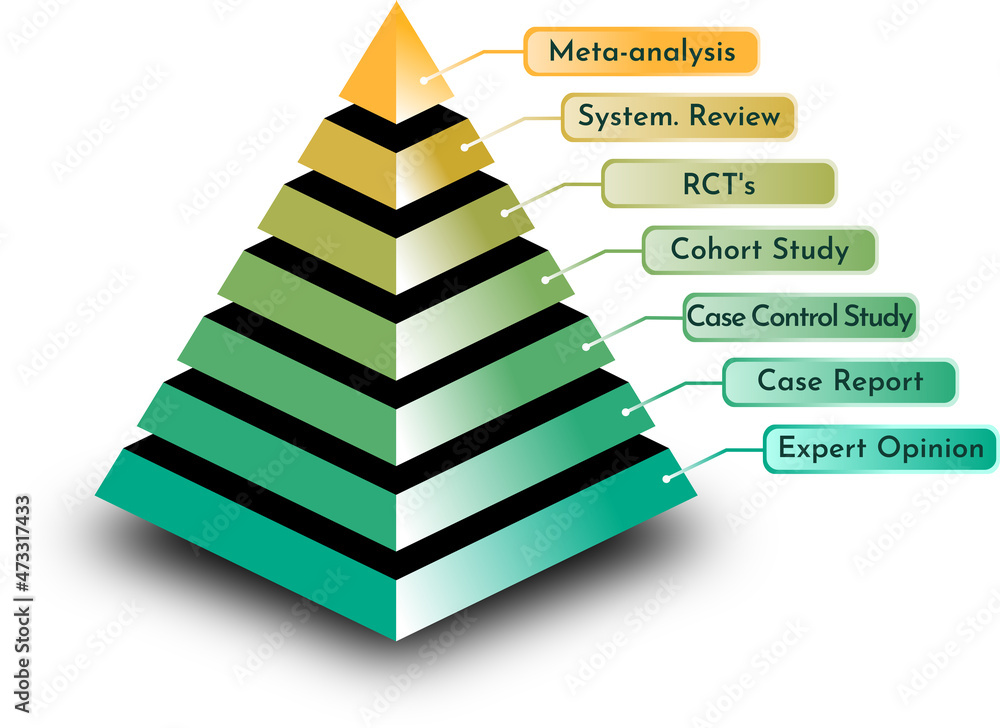
En teoría, ambos parámetros deberían estar alineados: recomendaciones fuertes deberían sustentarse en evidencia de alta calidad, mientras que evidencia limitada debería traducirse en recomendaciones más débiles. Sin embargo, los resultados del estudio sugieren que esta relación no siempre se cumple. Aunque la concordancia global entre LOE y SOR fue moderada, hasta un 73% de las recomendaciones clasificadas como fuertes se basaban en niveles de evidencia inferiores al esperado o no contaban con una asignación clara de calidad de evidencia. En otras palabras, muchas intervenciones que las guías recomiendan con firmeza podrían estar sustentadas en evidencia moderada, débil o incluso en consenso experto.
¿Significa esto que las guías están equivocadas?
No necesariamente. Existen contextos clínicos —como enfermedades graves, situaciones urgentes o escenarios donde la investigación experimental es difícil o éticamente inviable— en los que la formulación de recomendaciones fuertes puede justificarse pese a la ausencia de ensayos clínicos robustos. No obstante, la falta de transparencia en la justificación de esta discordancia puede dificultar la interpretación crítica de las recomendaciones por parte de los clínicos que las aplican.
Dado que las GPC orientan de manera directa la implementación de intervenciones terapéuticas, estas recomendaciones determinan en última instancia la exposición de los pacientes a tratamientos farmacológicos concretos. En este sentido, cabe preguntarse: ¿hasta qué punto algunas estrategias terapéuticas ampliamente utilizadas se apoyan en e un balance beneficio-riego realmente bien establecido? ¿Podría la emisión de recomendaciones fuertes en ausencia de evidencia robusta contribuir, indirectamente, a la adopción de intervenciones cuyo perfil de seguridad no esté plenamente definido?
Reforzar la transparencia en el proceso de elaboración de las recomendaciones, especialmente cuando su fuerza no se corresponde con la calidad de la evidencia disponible, podría facilitar una toma de decisiones más informada y crítica. En última instancia, comprender qué hay detrás de una recomendación no solo permite optimizar la práctica clínica, sino también avanzar hacia una medicina más segura, prudente y verdaderamente basada en la evidencia.
Rocio Rodas
R2. Farmacología Clínica